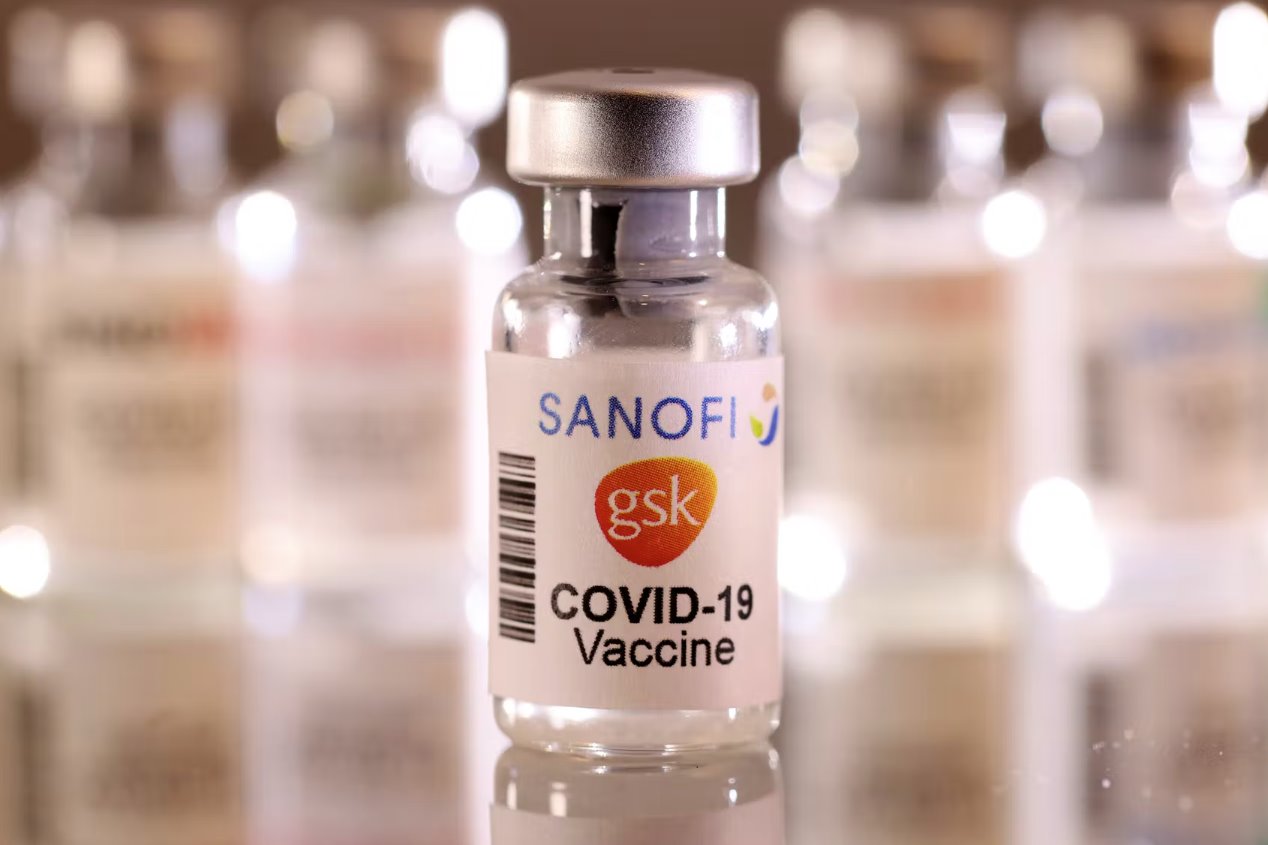
歐盟的藥品監管機構已開始審查賽諾菲及其英國合作伙伴葛蘭素史克的申請,該申請為他們的 COVID-19 疫苗尋求有條件的授權。
制藥商早些時候曾表示,他們將尋求監管部門批準他們的 COVID-19 疫苗用作助推器和獨立的兩劑疫苗。
制藥商在一封電子郵件中表示,為支持兩家公司的申請,最終數據包包括疫苗的后期試驗和另一項作為助推器的試驗,已于 3 月 29 日提交給歐洲藥品管理局(EMA)。路透社。
上個月,兩家公司表示,加強試驗的最終分析包括參與者之前基于 mRNA 技術或腺病毒病毒載體進行的注射,結果表明它可以將中和抗體增加 18 到 30 倍。
該疫苗作為獨立的兩劑疫苗的后期試驗的早期數據顯示,它對嚴重的 COVID-19 和住院治療有 100% 的有效性。
候選疫苗 Vidprevtyn 已經在 EMA 的滾動審查下進行評估。
賽諾菲計劃在法國、意大利和美國生產疫苗,希望在 COVID-19 疫苗的競爭中落后后卷土重來。
葛蘭素史克的一位發言人說,這些公司將在未來幾周內向美國食品和藥物管理局和其他與他們簽訂了預先采購協議的國家的監管機構提交最終申請。
兩家公司都表示,他們無法推測監管批準的時間表,但正在與衛生當局進行對話,以確保他們擁有盡快批準疫苗所需的所有信息。
2020年,歐盟同意購買3億劑疫苗,以換取3.24億歐元的首付。
本文“”來源:http://www.rrkkj.com/yiqing/1211.html,轉載必須保留網址。(編輯:頭條新聞)